藥品專利補交實驗數據的問題研究及審理建議
來源:wxw 發布日期:2022-12-28 瀏覽:77901
引 言
2021年1月15日開始實施的《專利審查指南》修改內容進一步明確了補交實驗數據的審查原則,并且增加了兩個藥品領域的案例予以舉例說明補交實驗數據可被接受的審查標準,形成具有普遍性與指導性的原則。
事實上,關于補交實驗數據審查標準自2020年初已經出現了積極的變化:中美雙方于2020年1月正式簽署的《中華人民共和國政府和美利堅合眾國政府經濟貿易協議》(簡稱中美貿易協定)中,針對“藥品相關的知識產權”作出規定,特別強調允許專利申請時補充數據、要求建立專利糾紛早期解決的有效機制。而后,同年9月份開始實施的《最高人民法院關于審理專利授權確權行政案件適用法律若干問題的規定(一)》(簡稱《專利確權司法解釋(一)》)中,第十條也明確對“藥品專利申請”中關于補交實驗數據的問題進行了規定:藥品專利申請人在申請日以后補交實驗數據,主張依賴該數據證明專利申請符合專利法第二十二條第三款、第二十六條第三款等規定的,人民法院應予審查。
基于上述系列協議、規定中呈現出的高度一致的“藥品專利補交實驗數據”觀點,也間接表明最高人民法院和國家知識產權局對于補交實驗數據的審查標準開始呈現更為統一的趨勢。
02
藥品專利補交實驗數據的特殊性
2.1 藥品行業的特殊性
不同于其他領域的產品一經生產即可迅速投放市場,藥品行業極具特殊性。除了眾所周知的上市之前的新藥研發時間長、失敗率高、風險大等特點,[1][2]新藥上市后的臨床使用過程中,極有可能存在NDA(NewDrugApplication,NDA)申請階段無法發現的安全性盲點,而這些盲點會直接導致藥品被強制撤市。近兩年以來,藥品撤回事件接連發生,其中包括適應癥“四連撤(羅氏、默沙東、阿斯利康、BMS)”的PD-1/L1,以及阿斯利康的新冠疫苗(AstraZeneca ,AZ疫苗)。

正是由于醫藥企業需要承擔上述的高成本、高風險,才使得藥品需要依靠專利獲得強有力的保護,保證醫藥企業能夠以“壟斷式”的姿態維持其所售藥品的高價格,進而保證其前期資本投入得以回收并帶來高額利潤,激發醫藥企業的新藥研發動力。
2.2 藥品專利的特殊性
專利是守護醫藥企業研發成果的城墻,以化藥企業為例,其命脈往往就是早期研發階段中形成的通式或具體化合物專利。針對專利申請,世界各國普遍實行“先申請原則”,加之企業之間天然存在競爭特性,為了搶占先機,醫藥企業通常都會在藥品研發的早期階段就針對藥品的核心成果進行專利申請和布局,同時由于不同國家或地區的專利審查標準存在差異,藥品領域的專利申請文件,往往具有以下特性:
(1)申請日掌握的實驗數據有限,申請日前尚未進行系統的臨床實驗,僅掌握有初步的藥效實驗數據;無法提供與藥品毒性、藥效活性、代謝穩定性以及給藥途徑等方面的深入、全面的研究數據;也無法確定藥品的優選方案;
(2)申請文件中存在部分聲稱卻缺乏實驗數據的技術效果,旨在通過后續的研究獲得支持上述技術效果的數據。
2.3 藥品專利實驗數據的特殊性
之所以“申請日后補交實驗數據的問題”能夠成為藥品類專利審查標準的關注重點,不僅取決于藥品行業、藥品專利的特殊性,另一重要的原因在于藥品專利的實驗數據所具有的特殊性:
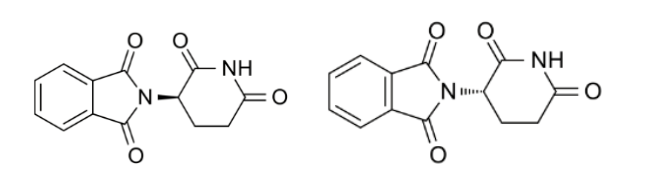
其一、其藥效難以通過藥品分子結構預測,必須結合實驗結果來證實。例如,瑞士CIBA公司研發的沙利度胺(Thalidomide,CAS號:50-35-1,化學名稱:N-(2,6-二氧代-3-哌啶基)-鄰苯二甲酰亞胺),其左旋異構體(R型)對妊娠期孕婦具有鎮靜止吐的作用,而右旋異構體(S型)對嬰兒具有強烈的致畸作用,僅手性原子構型的不同即可能產生完全不同的藥效或藥品毒性。
其二、藥品的考察標準多維、且過程復雜、周期長,單就藥品臨床試驗一般就包括I、II、III、IV期臨床試驗及生物等效性試驗。I期臨床試驗涉及安全性、毒性、藥代動力學及耐受性(最大耐受劑量)的考察;II期臨床試驗涉及藥品有效性及受益/風險比、耐受性(最小耐受劑量)的考察;III期臨床試驗涉及藥品對目標適應癥患者的治療作用和安全性驗證,觀察不常見或遲發的不良反應,獲取更豐富的藥品安全性和療效方面的資料,確定理想用藥劑量方案;IV期臨床試驗考察廣泛使用條件下的藥品療效和罕見不良反應,在普通人群或特殊人群中使用的受益及風險關系,改進給藥劑量,以及發現新的適應癥[3];生物等效性試驗以藥代動力學參數為指標,比較同一種藥品的相同或者不同劑型的制劑,在相同的試驗條件下,其活性成份吸收程度和速度有無統計學差異的人體試驗[4]。
基于上述,涵蓋適應癥種類以及針對每一適應癥的治療效果均可以視為藥品類專利的技術效果,比如高活性、低毒性、緩釋性、給藥途徑、儲存穩定性、易加工性等,均可以作為藥品專利應予考慮和接受的技術效果。由此藥品專利的實驗數據呈現出了與其他技術領域不同的特點。
03
我國關于補交實驗數據的規定研究
3.1 《專利審查指南》關于補交實驗數據的規定
關于申請日之后補交提交實驗數據的問題,并未記載在我國現行的《專利法》及《專利法實施細則》中,而記載在《專利審查指南》中。隨著我國經濟社會的發展,《專利審查指南》中關于補交實驗數據的問題也經歷了長久、反復的變化過程。
如圖3所示,自1993年至2017年各版的《專利審查指南》,關于申請日后補交實驗數據的相關規定,經歷了由“允許”-“提供”-“記載”-“得到”四個階段。補交實驗數據的情形,經歷了由“寬松”到“嚴格”,再由“嚴格”到“寬松”的狀態。
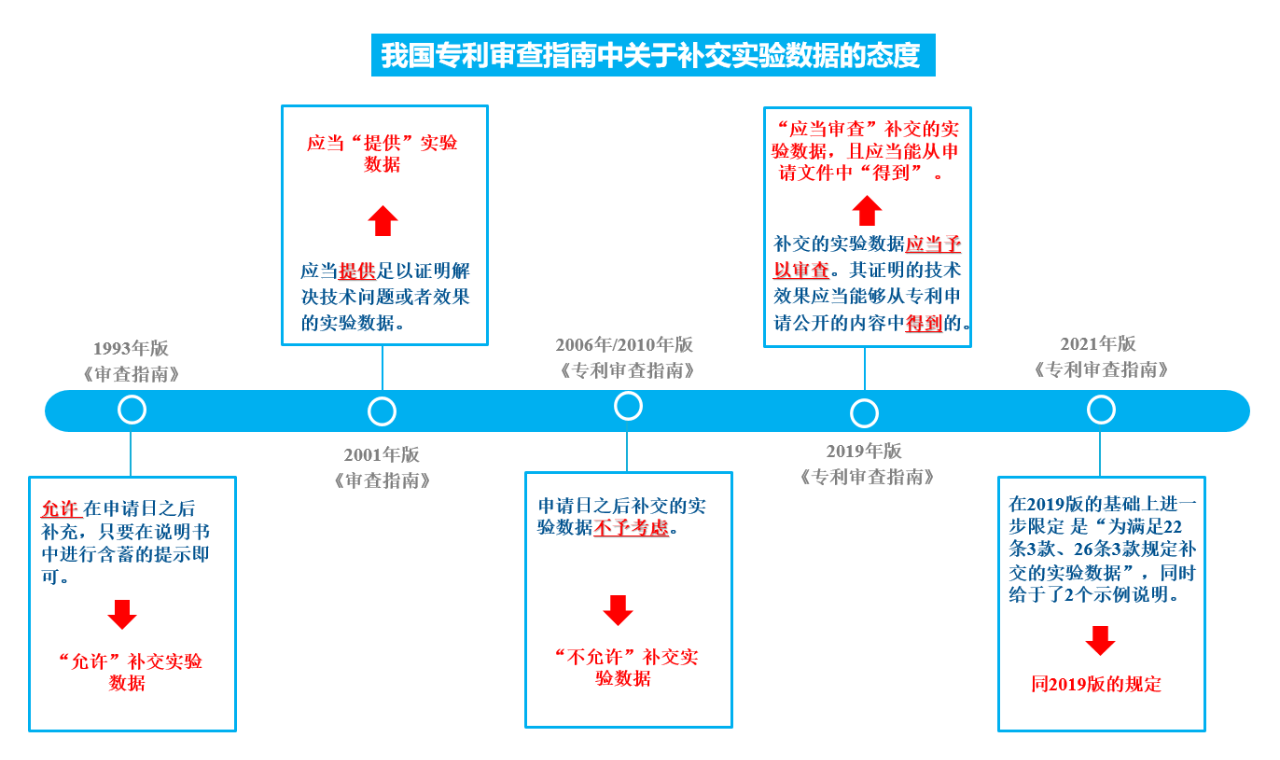
圖3 我國專利審查指南中關于補交實驗數據的態度
2019年版的《專利審查指南》對申請日之后補交實驗數據的問題進行了修改,首先明確對補交的實驗數據應當予以審查,其次又明確規定了補交的實驗數據所能被接受的要求,即“補交實驗數據所證明的技術效果應當是所屬技術領域的技術人員能夠從專利申請公開的內容中得到的”;2021年版的《專利審查指南》在2019年版的基礎上,進一步的把補交實驗數據能夠被接受的要求限定在用于證明《專利法》第22條3款創造性、第26條3款公開充分兩個方面;并且《專利審查指南》在第3.5.2節中給出了兩個典型審查示例,分別涉及說明書充分公開和創造性審查中有關補交實驗數據的典型情形,為補交的實驗數據的審查提供了具有參考性的案例和借鑒標準。
3.2 司法程序關于補交實驗數據的規定
最高人民法院于2021年9月的《專利確權司法解釋(一)》也對申請日之后補交實驗數據的問題予以確認。《專利確權司法解釋(一)》的第十條,規定藥品專利申請人在申請日以后補交實驗數據,主張依賴該數據證明專利申請符合專利法第二十二條第三款、第二十六條第三款等規定的,人民法院應予審查。
基于新的司法解釋,最高人民法院于2020年10月26日作出(2019)最高法知行終33號判決[5],該判決中最高人民法院認為:“基于對現有技術的認知差異、對技術方案發明點的理解不同、對本領域技術人員認知水平的把握不一致等,申請人在原申請文件中未記載特定實驗數據的情形是難以避免的……上述情況下,專利申請人均需要依靠在申請日或者優先權日之后提交的補交實驗數據證明其專利申請符合授權條件”。因此,最高人民法院認為申請日之后提交的補交實驗數據應當予以審查。
3.3 相關規定與我國醫藥企的發展相適應
我國自1993年至2017年經過多次對補交實驗數據規定的修改,逐漸有與美國等發達國家接軌的趨勢,要求實驗數據要能從原始文件中“得到”,但總體上的要求還是偏于嚴格。后續,美國貿易代表辦公室(簡稱USTR)接連于2018年至2020年的《特別301報告》[6][7][8]中對中國藥品專利申請及審查方面補交實驗數據的問題進行提及。至此,我國關于補交實驗數據的審查標準也于2020年開始出現“逐漸放開”的變化。
我國對于補交實驗數據審查標準的變化,固然有來源于歐美等地區外在壓力的影響,但主要還是取決于我國制藥產業發展的客觀需要。從2009年~2018年,我國本土企業的(一類)上市新藥僅有20個[9],而2019年~2021年我國本土企業上市新藥達到48個,這說明我國藥企的自主研發能力逐漸增強,中國醫藥企業在國際產業價值鏈的地位也不斷提升,我國越來越多的創新藥企業也需要得到更強力度的專利保護,從而才能更好依靠專利權在特定時間的壟斷而激發創新藥企業的創新動力。因此,我國針對補交實驗數據的審查標準的變化也是為了更好的促進我國醫藥產業的創新發展。
04
針對補交實驗數據審理建議
補交實驗數據是否予以接受是醫藥專利授權和確權程序的關鍵所在,補交實驗數據是否采納關乎到專利權人利益與社會公眾利益之間的平衡,必須要在維護“先申請原則”的基礎上保證專利權人的利益。雖然,為了適應我國醫藥產業的發展、激發藥企的創新活力,最高人民法院和國家知識產權局針對補交實驗數據的標準都逐漸寬松,但目前補交實驗數據的證明規則尚不明確。因此,建議針對補交的實驗數據采取“實驗數據的審查”-“實驗數據的采納”-“待證事實的證明力”的三步法進行判斷。
4.1 針對補交實驗數據的審查
2021年版的《專利審查指南》及2020年9月10日發布的《專利確權司法解釋(一)》,均明確了在申請日或者優先權日之后補交實驗數據應當予以審查,為申請人在原申請文件中未記載特定實驗數據的情形提供了救濟途徑,從而保證專利權人在授權或者確權過程中針對補交實驗數據的發言權,避免出現針對補交實驗數據不予審理和不予認可的情形發生。
同時對補交實驗數據的真實性、合法性進行審理,排除非法證據和真實性存疑的證據。針對補交的實驗數據,如果具有權威第三方中立機構檢測報告以及送檢過程公證記錄則認為具有較強的可信度,或者申請人提交的原始實驗記錄、原始檢測結果和研發過程記錄也可以提高證據的可信度。
但是,法院及國家知識產權局的審查人員不能武斷要求申請人提交的補交實驗數據必須形成于申請日或者優先權日之前。此外,也不能以補交實驗數據的來源與專利權人具有雇傭等利害關系作為拒絕的絕對理由。
4.2 針對補交實驗數據的采納
在審查的基礎上對補交實驗數據進行進一步的分析,從而判斷補交的實驗數據是否予以采納。
(1)應當分析補交的實驗數據是否違反先申請原則,避免專利申請人將申請日以后的內容補充到原始申請文件中;如果申請日后補交的實驗數據會導致增加和/或改變原始申請文件中所記載的專利權保護范圍,或者企圖彌補原專利申請文件存在的公開不充分等固有內在缺陷,則補交的實驗數據均不應該被接受。
(2)需要審查所補交的實驗數據能否從原始申請文件中得到,即補交實驗數據所證明的技術效果應當是原始申請文件中已經記載或者隱含公開的具體活性或者藥效,而并非通過申請日補交實驗數據從眾多可能的優勢效果中確認選擇一種特定活性或者藥效;而且,補交實驗數據所證明的技術效果應當是針對申請文件中具體化合物的技術效果,避免通過補交實驗數據從包含多個化合物的通式中篩選優選化合物的情形。
(3)對補交實驗數據整體的邏輯性進行判斷,首先分析補交實驗數據是否符合藥品的研發規律和研發實踐;其次結合最接近現有技術、原始申請文件中記載的內容和專利權利要求請求保護技術方案的范圍共同分析實驗數據的邏輯性,進而確定補交的實驗數據是否予以采納,對違反研發邏輯或者技術邏輯的實驗數據不予接受。
<

